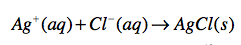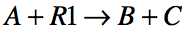Caractérisation et Dosage d’ions dans des solutions aqueuses du quotidien
Niveau Terminale (et +)
Introduction
Les ions sont des molécules ou des atomes électriquement chargés que l’on retrouve en solution. En effet dans le cas d’une solution aqueuse, c’est la polarité de la molécule d’eau qui permet de disperser et de stabiliser les charges positives et négatives.
Le nom « ion » a été donné en 1834 par le physicien Michael Faraday pour désigner les espèces chimiques responsables de la conductivité électrique dans les solutions.
On distingue deux catégories d’ions : les cations (chargés positivement) et les anions (chargés négativement). Ces ions rentrent en jeu lors de réactions de précipitation et de complexation qui permettent leur caractérisation et leur dosage dans certains cas. De plus, ils assurent la conductivité d’une solution permettant ainsi une étude potentiométrique.
Les ions sont dotés de propriétés spécifiques :
• physiques : absorption ou émission lumineuse…
• chimiques : acido-basicité, oxydoréduction, complexométrique…
Ces propriétés permettent de les caractériser.
Nous allons au cours de cet exposé, caractériser et doser des ions que l’on trouve dans des solutions utilisées couramment comme une eau minérale, un antiseptique ou bien un vin blanc. Nous verrons ainsi différentes méthodes de dosage et de caractérisation d’ions.
Rappelons que doser une espèce chimique en solution c’est déterminer sa concentration (molaire ou massique) dans la solution considérée. Une réaction de dosage doit être unique, rapide et totale.
I. Les ions chlorure dans le sérum physiologique
Le sérum physiologique est composé d’eau distillée et de chlorure de sodium. Cette solution est utilisée en médecine pour nettoyer le nez, les yeux ou les oreilles. Nous allons tout d’abord caractériser la présence d’un anion, en l’occurrence l’ion chlorure dans le sérum physiologique, puis doser cet anion par précipitation.
1. Mise en évidence
Dans un tube à essais, on verse 2mL de sérum physiologique auquel on ajoute quelques gouttes de nitrate d’argent AgNO3 à 0,1 mol/L.
On constate l’apparition d’un précipité blanc de chlorure d’argent AgCl qui noircit à la lumière. Ce test est caractéristique des ions chlorure.
Équation de la réaction :
2. Dosage des ions chlorure Cl– par la méthode de Mohr
On dose 10,0 mL de sérum physiologique dans un bécher ou un erlenmeyer par une solution de nitrate d’argent AgNO3 à 0,100 mol/L.
Observation
On voit d’abord apparaître un précipité blanc de chlorure d’argent AgCl. Dès que tous les ions chlorure Cl– présent dans le sérum phy ont été consommés, les ions argent Ag+ vont complexer avec les ions chromate CrO42-. Ce complexe est de couleur rouge saumon. Il apparaît dès que les ions argent sont en excès et nous permet donc de repérer l’équivalence.
Interprétation
Equations de dosage :
A l’équivalence, on a :
On trouve Veq = 13,2mL soit [Cl–] = 0,132 mol/L
La concentration des ions Cl– dans le sérum physiologique est donc de 0,132 mol/L.
Remarque : ce dosage ne possède pas une grande finesse de mesure car l’équivalence n’est pas bien définie à l’oeil nu. Il est donc difficile de voir le virement. On aurait pu aussi réaliser un dosage conductimétrique ou bien un dosage potentiométrique avec une électrode mesure (en argent) et une électrode de référence (ECS + Allonge), à l’équivalence on aurait alors visualiser un saut de potentiel. En effet, avant l’équivalence la concentration en ion argent [Ag+] est faible alors qu’après l’équivalence on en rajoute : on observerait alors un saut de potentiel !!
Nous avons ici réalisé un dosage direct puisqu’on a repéré l’équivalence directement grâce à l’espèce à doser : on ajoute le réactif adéquat jusqu’à l’équivalence. Nous allons maintenant réaliser un dosage indirect.
Le dosage indirect met en jeu deux transformations successives. Pour la première, on ajoute un excès connu d’un réactif R1 à une prise d’essai A à doser.
Puis on réalise une deuxième transformation : par titrage direct on dose :
- soit R1 restant, et par différence on calcule la quantité initiale de A dans la prise d’essai (dosage par différence)
- soit les quantités de C ou D formées (dosage par retour).
II. Les ions hypochlorite ClO- dans une solution antiseptique de Dakin®
La solution de Dakin® est un antiseptique utilisé pour le lavage des plaies et des muqueuses. Elle a une couleur rose (à cause des ions MnO4–) et une odeur chlorée. Le principe actif de cette solution de Dakin® est de l’eau de javel diluée soit de l’hypochlorite de sodium NaClO.
L’antiseptie (selon la norme AFNOR) est « une opération au résultat momentané permettant au niveau des tissus vivants, dans la limite de leur tolérance, d’éliminer ou de tuer les micro-organismes et/ou d’inactiver les virus en fonction des objectifs fixés. Le résultat de cette opération est limité aux micro-organismes et/ou virus présents au moment de l’opération. »
La solution de Dakin® est donnée pour contenir « 0,5g de chlore actif dans 100mL ». Cela signifie que 100mL de solution peut libérer 0,5g de dichlore selon la réaction de médiamutation :![]()
C’est ce que nous allons vérifier ici.
Nous réalisons le dosage des ions hypochlorite ClO– contenus dans le Dakin à l’aide d’une solution de thiosulfate par la méthode de Bunsen. Pour cela, on pipette 5,0mL de la solution de Dakin® qu’on transvase dans un bécher (ou un erlenmeyer) de 100mL, puis on ajoute 10mL de la solution à 15% de KI et 5mL de solution de CH3COOH à 3,0 mol/L à l’aide d’une éprouvette graduée. L’acide acétique doit être introduit en dernier pour éviter la formation d’acide hypochloreux instable. On dose ensuite la solution obtenue par la solution de thiosulfate à 0,050 mol/L jusqu’à ce que la solution devienne incolore.
C’est un dosage indirect car on va doser le diiode formé par la réaction entre les ions hypochlorite ClO– et les ions iodure ClO– en milieu acide.
ClO– est le réactif limitant. On dose donc ensuite le diiode formé par la solution de thiosulfate de sodium.
Dans V = 100mL de Dakin®, on a donc :
Ce résultat est en accord avec la valeur annoncée par le laboratoire « 0,5g de chlore actif pour 100mL ».
Nous venons ainsi de doser les ions hypochlorite dans la solution de Dakin® par oxydoréduction. C’est un dosage volumétrique indirect, puisqu’on dose I2 formé au cours de la première réaction.
Nous allons nous intéresser à une troisième méthode de dosage des ions : le dosage spectrophotométrique qui est un dosage non destructif.
III. Les ions ferriques Fe3+ et ferreux Fe2+ dans un vin blanc
Le vin, comme de nombreuses boissons est acide ; au contact d’objets ferreux il se charge d’ions fer(II) qui, pour partie se transforment en ions fer(III) en présence du O2 de l’air.
Au cours de son stockage, un trouble peut apparaître. Ce trouble, appelé casse ferrique ou casse blanche, constitué d’un précipité de phosphate de fer (III) FePO4, est peu attrayant et gênant sur le plan gustatif. Un vin présente un risque de casse lorsque sa teneur globale en élément fer (ions fer (II) et ions fer (III)) dépasse, selon le type de vin : 10 à 20 mg/L.
1. Mise en évidence des ions ferriques et ferreux dans le vin blanc
On cherche à mettre en évidence la présence de ces ions dans le vin. Pour cela on va caractériser leur présence par la soude NaOH. Il faut utiliser une soude assez concentrée.
Pour commencer, on oxyde tout les ions fer(II) avec de l’eau oxygénée car c’est eux que l’on veut doser. Lorsqu’on ajoute de la soude, il se forme un précipité orange de Fe(OH)3. Ce test est caractéristique des ions Fe3+.
Pour caractériser les ions ferriques, on pourrait aussi ajouter quelques gouttes orthophénantroline et observer la formation d’un complexe bleu pale de [Fe(ophen)3]3+.
2. Dosage spectrophotométrique des ions ferriques
Nous venons de caractériser les ions ferriques dans le vin. Nous allons maintenant chercher à les doser.
Nous allons d’abord oxyder les ions Fe2+ en Fe3+. On réalisera ensuite un dosage spectrophotométrique. Celui-ci nécessite la création d’une courbe d’étalonnage à partir de plusieurs solutions d’ions fer(III) à différentes concentrations (5 fioles jaugées). On part d’une solution mère de concentration C0 = 1,0.10-3 mol/L pour fabriquer les solutions filles dont on va mesurer l’absorbance. Pour ce faire, on choisit de se placer à 465 nm où l’absorbance est maximale.
Nous préparons une échelle de teinte à partir de la solution mère suivant ce tableau :
On ajoute ensuite dans chaque solution :
• 2 ou 3 gouttes d’acide sulfurique (il faut un pH assez acide)
• 1mL de KSCN
• quelques gouttes d’H2O2
En présence de SCN–, on forme le complexe Fe(SCN)2+ rouge sang.
Attention :
• le milieu ne doit pas être excessivement acide car SCN– n’est pas stable en milieu sulfurique concentré.
• SCN– doit être en large excès
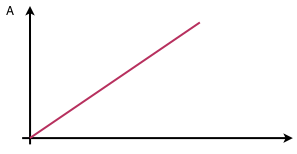
Mesurer ensuite l’absorbance de chaque solution pour λ = 465nm et tracer la courbe d’étalonnage A = f([Fe3+]).
On obtient une droite passant par l’origine. On a une relation de proportionnalité. Il s’agit de la relation empirique reliant l’absorption de la lumière aux propriétés des milieux qu’elle traverse : c’est la loi de Beer-Lambert. L’intensité du rayonnement subit une diminution en fonction de la distance parcourue et de la densité des espèces absorbantes dans ce milieu.
 On retrouve ainsi la loi liant l’absorption d’un faisceau de lumière monochromatique dans un milieu homogène et isotrope, à la concentration.
On retrouve ainsi la loi liant l’absorption d’un faisceau de lumière monochromatique dans un milieu homogène et isotrope, à la concentration.
La courbe d’étalonnage obtenue est la suivante :
On réalise ensuite le même protocole pour un échantillon du vin dont on veut donner la teneur en ion ferrique. Il faudra préalablement décolorer le vin blanc à l’aide d’une ou deux spatules de noir animal en agitant puis en filtrant.
On mesure ensuite son absorbance à l’aide du spectrophotomètre et on reporte directement la valeur obtenue sur la droite d’étalonnage. On en déduit ainsi la concentration de [Fe3+] du vin. Si cette valeur est supérieure à 10-20 mg/L alors ce vin présentera un risque de casse ferrique.
Conclusion
Dans cet exposé expérimental, nous avons donc réalisé des analyses qualitatives avec les tests caractéristiques de quelques ions et des analyses quantitatives avec les dosages.
On a caractérisé les ions par leurs propriétés chimiques (réactions de précipitation). On aurait pu également les caractériser par leurs propriétés physiques : par exemple l’ion Cu2+ est bleu en solution (propriété d’absorption).
On a vu également qu’il existait plusieurs types de dosage. Les dosages volumétriques qui mettent en jeu une réaction chimique entre l’espèce en solution dont on cherche à déterminer la concentration et une espèce de concentration connue dans une solution dite titrante. Les dosages non destructifs qui sont liés à la mesure d’une grandeur physique proportionnelle à la concentration de l’espèce active et qui nécessitent un étalonnage…